Lopende klinische studies
Lopende klinische studies
Het Universitair Medisch Centrum Groningen (UMCG) en het Medisch Centrum Leeuwarden (MCL) doen sinds 2004 gezamenlijk onderzoek naar axiale SpA binnen het ‘Groningen Leeuwarden Axiale Spondyloartritis’ (GLAS) cohort. Dit cohort onderzoek is ingebed in de dagelijkse klinische praktijk. Het algemene doel van het GLAS cohort is de ziekte nauwkeurig monitoren en meer kennis verkrijgen over het lange termijn beloop van de ziekte. Momenteel worden binnen het GLAS cohort meer dan 900 patiënten gevolgd en daarmee is het GLAS cohort een uniek, groot cohort van patiënten met axiale SpA in Noord Nederland.
Hieronder volgt een overzicht van de onderwerpen waar we momenteel mee bezig zijn.
Radiografische versus niet-radiografische axiale SpA
Al lange tijd wisten we van het bestaan van ‘spondylitis ankylopoëtica’ af. Vroeger noemden we dit de ziekte van Bechterew, tegenwoordig radiografische axiale spondyloartritis (SpA). Het belangrijkste kenmerk van deze ziekte is een ontsteking van de ruggengraat en de twee gewrichten tussen de wervelkolom en het bekken (de zogenaamde SI-gewrichten), waarbij deze SI-gewrichten op een röntgenfoto duidelijk beschadigd zijn. Toch zijn er veel mensen die wel dezelfde symptomen hebben als mensen met spondylitis ankylopoëtica, maar die geen beschadigde SI-gewrichten hebben op de röntgenfoto. Met behulp van onder andere MRI-scans en nieuw onderzoek zijn we erachter gekomen dat deze mensen inderdaad een vergelijkbare ziekte hebben – deze ziekte noemen we sinds 2009 niet-radiografische axiale SpA. We weten dat een deel van de patiënten met niet-radiografische axiale SpA op een gegeven moment wel schade ontwikkelt aan de SI-gewrichten en dus het diagnose ‘radiografische axiale SpA’ gaat krijgen. Maar bij veel mensen raken deze gewrichten nooit beschadigd.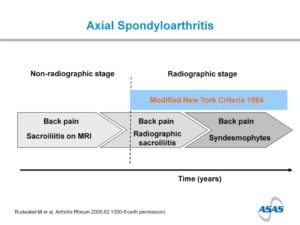
In ons onderzoek binnen het GLAS cohort kijken we naar de verschillen in patiënt karakteristieken en respons op behandeling tussen patiënten met radiografische en niet-radiografische axiale SpA. Dit geeft ons een beter beeld van individuele verschillen en helpt ons uiteindelijk verder in ons doel om iedere patiënt met axiale SpA een behandeling op maat te geven.
Botstofwisseling bij axiale SpA: observeren, analyseren en reduceren
Het onderliggende ontsteking gerelateerde ziekteproces bij axiale SpA verstoort de balans tussen botaanmaak en botafbraak. Deze verstoring in de botstofwisseling kan onder andere leiden tot osteoporose, in de volksmond ook wel botontkalking genoemd, en het ontstaan van onomkeerbare schade aan de wervellichamen, zogenaamde ankylosering van de wervelkolom.
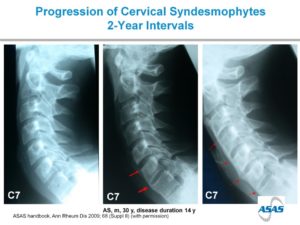 Sinds 2000 zijn anti-TNFα biologicals (zoals etanercept of adalimumab) beschikbaar voor patiënten met axiale SpA bij wie de ziekteactiviteit niet voldoende kan worden geremd met reguliere ontstekingsremmende middelen. Recenter zijn ook anti-IL17 biologicals (zoals secukinumab) beschikbaar gekomen. Voor ons onderzoek binnen het GLAS cohort naar het effect van deze biologicals op de botstofwisseling hebben wij de volgende doelen gesteld:
Sinds 2000 zijn anti-TNFα biologicals (zoals etanercept of adalimumab) beschikbaar voor patiënten met axiale SpA bij wie de ziekteactiviteit niet voldoende kan worden geremd met reguliere ontstekingsremmende middelen. Recenter zijn ook anti-IL17 biologicals (zoals secukinumab) beschikbaar gekomen. Voor ons onderzoek binnen het GLAS cohort naar het effect van deze biologicals op de botstofwisseling hebben wij de volgende doelen gesteld:
– Onderzoeken wat het effect is van langdurig (8-10 jaar) anti-TNFα biological gebruik op de botstofwisseling. Hierbij kijken we naar stoffen in het bloed (biomarkers), maar maken we ook gebruik van gegevens afkomstig van de botdichtheidsmeting en röntgenfoto’s.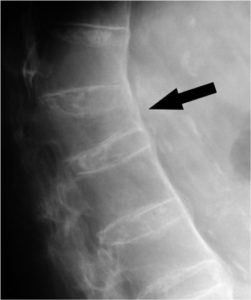
– Onderzoeken wat het effect is op kortere termijn (1-2 jaar) van anti-IL17 biological gebruik op de botstofwisseling, ook in vergelijking met het effect van de al langer beschikbare anti-TNFα biologicals.
– Achterhalen of we het ontstaan en de ernst van radiologische schade kunnen voorspellen door het vinden van een zogenaamde biomarker in het bloed.
Extra-articulaire manifestaties
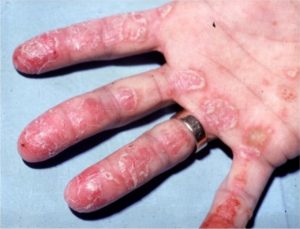
Ontstekingen bij axiale SpA kunnen optreden in de wervelkolom, SI-gewrichten en perifere gewrichten (zoals de knie of schouder). Naast chronische pijn en stijfheid van de rug kunnen zogenaamde extra-articulaire manifestaties optreden; ontstekingen buiten de gewrichten. Ontstekingen van de darm (inflammatoire darmziekte), huid (psoriasis) of oog (uveitis anterior) komen vaak voor bij patiënten met axiale SpA. Deze manifestaties zijn onderdeel voor het vaststellen van axiale SpA (classificatie criteria) en kunnen bepalend zijn voor behandelbeslissingen. Daarnaast hebben we recent een verband aangetoond tussen een andere huidziekte (hidradinitis supperativa) en axiale SpA.
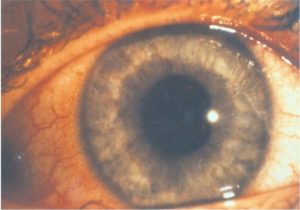 In dit onderzoek kijken we naar hoe vaak deze extra-articulaire manifestaties optreden bij patiënten met axiale SpA, wat het effect is van behandeling en wat de impact is op kwaliteit van leven. Hierbij wordt samengewerkt tussen de afdelingen reumatologie, maag-darm-leverziekte en dermatologie, zowel klinisch als in het onderzoek.
In dit onderzoek kijken we naar hoe vaak deze extra-articulaire manifestaties optreden bij patiënten met axiale SpA, wat het effect is van behandeling en wat de impact is op kwaliteit van leven. Hierbij wordt samengewerkt tussen de afdelingen reumatologie, maag-darm-leverziekte en dermatologie, zowel klinisch als in het onderzoek.
Betrokkenheid van peesaanhechtingen en heupgewrichten
Ontstekingen van de peesaanhechtingen en betrokkenheid van de heupgewrichten (dit samen wordt ook wel perifere betrokkenheid genoemd) komen vaak voor bij patiënten met een axiale SpA. Deze zogenaamde perifere betrokkenheid leidt tot pijnklachten en mogelijk functionele beperkingen. Het vaststellen van ontsteking van de peesaanhechting (enthesitis) d.m.v. lichamelijk onderzoek is moeilijk. Echografisch onderzoek van peesaanhechtingen en heupgewrichten kan zowel actieve ontsteking alsmede eventueel ontstane schade zichtbaar maken. Onderzoek heeft aangetoond dat echografisch aangetoonde ontsteking van de peesaanhechting frequent voorkomt bij patiënten met actieve axiale SpA. In geval van ontsteking van de heupgewrichten kan echografie zinvol zijn om het effect van behandeling te evalueren.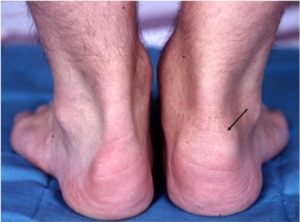
Op röntgenfoto’s kan schade ten gevolge van een ontsteking van de peesaanhechting worden gezien. Het kan dan gaan om aantasting van het bot (erosies) of botwoekering (enthesofyt) op de plek van de peesaanhechting. Momenteel onderzoeken we of deze afwijkingen vaker voorkomen op de bekkenfoto bij patiënten met axiale SpA.
Belang van fysieke activiteit
Dagelijkse fysieke activiteit is een van de belangrijkste aspecten voor het behoud en verbeteren van onze gezondheid. Patiënten met axiale SpA geven aan dat vermoeidheid en conditieverlies grote invloed hebben op hun dagelijks functioneren. Daarom wordt het onderhouden en verbeteren van fysieke activiteit beschouwd als een belangrijk onderdeel van de behandeling. Met als doel om de kwaliteit van het leven te verbeteren. Er is helaas echter weinig bekend over welke activiteiten met bijbehorende duur en intensiteit het meest geschikt zijn voor patiënten met axiale SpA. Een valide en betrouwbaar meetinstrument is essentieel voor het ontwikkelen van goede richtlijnen voor fysieke activiteit en het onderzoeken van de relatie van fysieke activiteit met ziekteactiviteit en andere uitkomsten van behandeling.
Daarom hebben we een vragenlijst ontwikkeld om de dagelijkse fysieke activiteit in kaart te brengen. Deze vragenlijst geeft direct inzicht in het huidige beweegpatroon. We hebben inmiddels de vragenlijst vertaald in het Engels, zodat ook andere landen hier gebruik van kunnen maken. Hierdoor hopen we in de toekomst steeds meer te weten te komen over fysieke activiteit met betrekking tot axiale SpA. Binnen het GLAS cohort onderzoeken we onder andere welke patiënten met axiale SpA het niet lukt genoeg te bewegen. We zagen hierbij dat mensen met meer angst of depressie klachten minder bewogen. Het lijkt erop dat de type coping stijl (hoe men omgaat met haar of zijn klachten) invloed heeft op hoeveel mensen bewegen en uiteindelijk daardoor ook op de kwaliteit van leven.
Spondyloartritis: To B or not to B?
Bij het ontstaan van reumatische ontstekingsziekten speelt het afweersysteem een belangrijke rol. Er zijn aanwijzingen dat bij deze ziekten veranderingen optreden in cellen van het afweersysteem. Voor dit onderzoek zijn we met name geïnteresseerd in veranderingen van specifieke afweercellen: de zogenaamde B-lymfocyten. Deze specifieke B-cellen zijn onderbelicht in onderzoek naar het ontstaan en het in stand houden van de ontstekingsziekte axiale SpA.
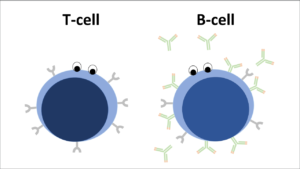 Momenteel doen we onderzoek naar deze B-cellen in het bloed van patiënten met axiale SpA en vergelijken we dit met de cellen in gezonde personen. Het doel is bij te dragen aan de kennis over de oorzaak en het ziekte beloop van axiale SpA. Op deze manier hopen we missende puzzelstukjes te vinden en daarmee de kennis rondom axiale SpA uit te breiden. Al met al hopen wij dat dit onderzoek uiteindelijk zal bijdragen aan het maken van de juiste behandelkeuze voor patiënten met een dergelijke aandoening.
Momenteel doen we onderzoek naar deze B-cellen in het bloed van patiënten met axiale SpA en vergelijken we dit met de cellen in gezonde personen. Het doel is bij te dragen aan de kennis over de oorzaak en het ziekte beloop van axiale SpA. Op deze manier hopen we missende puzzelstukjes te vinden en daarmee de kennis rondom axiale SpA uit te breiden. Al met al hopen wij dat dit onderzoek uiteindelijk zal bijdragen aan het maken van de juiste behandelkeuze voor patiënten met een dergelijke aandoening.
Chronische inflammatoire rugpijn in de algemene bevolking
Chronische rugpijn komt heel vaak voor. In sommige gevallen is de ziekte axiale SpA hiervan de oorzaak. Chronische rugpijn door axiale SpA heeft vaak een aantal ontstekingskenmerken, waarmee deze zogenaamde ‘inflammatoire rugpijn’ onderscheiden kan worden van rugpijn door een andere oorzaak. Daarnaast hebben patiënten met axiale SpA veel vaker dan gezonde mensen het HLA-B27 gen.
Het doel van dit onderzoek is om meer inzicht te krijgen in hoe vaak chronische inflammatoire lage rugpijn en de genetische factor HLA-B27 voorkomen in de algemene Nederlandse bevolking. Mensen met deze kenmerken zouden mogelijk axiale SpA kunnen hebben. Daarnaast onderzoeken we welke verbanden er zijn tussen deze kenmerken en demografische en klinische gegevens zoals medicatie gebruik. Hiervoor worden de gegevens van 90.000 deelnemers van het noord Nederlandse Lifelines cohort gebruikt.
Chronische pijn bij axiale SpA
Chronische (rug)pijn is één van de belangrijkste symptomen bij patiënten met axiale SpA en heeft grote invloed op het dagelijks functioneren. Patiënten met axiale SpA kunnen niet doen wat zij willen doen, ze passen hun leven voortdurend aan vanwege pijn en dit heeft daardoor enorm veel invloed op de kwaliteit van leven. Ondanks de toegenomen medicamenteuze behandelopties gericht op het remmen van ontsteking, houdt bijna 50% van de patiënten met axiale SpA chronisch (rug)pijn.
 Uit eerder onderzoek is gebleken dat bij patiënten met chronische pijn, de zogenoemde gevaarboodschappen (ook wel sensorische prikkels genoemd) veel minder worden geremd in de hersenen en het ruggenmerg dan bij gezonde proefpersonen, waardoor zij zeer waarschijnlijk vaker en meer pijn ervaren. Het centrale zenuwstelsel heeft invloed op de pijnervaring, door zowel dempende als faciliterende systemen. Deze systemen kunnen ook wel gezien worden als een soort volumeknop die voor de gevaarboodschappen kan worden open-of dichtgedraaid. Door langdurige pijn kan het centrale zenuwstelsel aanpassen, het aanpassen van het
Uit eerder onderzoek is gebleken dat bij patiënten met chronische pijn, de zogenoemde gevaarboodschappen (ook wel sensorische prikkels genoemd) veel minder worden geremd in de hersenen en het ruggenmerg dan bij gezonde proefpersonen, waardoor zij zeer waarschijnlijk vaker en meer pijn ervaren. Het centrale zenuwstelsel heeft invloed op de pijnervaring, door zowel dempende als faciliterende systemen. Deze systemen kunnen ook wel gezien worden als een soort volumeknop die voor de gevaarboodschappen kan worden open-of dichtgedraaid. Door langdurige pijn kan het centrale zenuwstelsel aanpassen, het aanpassen van het centrale zenuwstelsel wordt ook wel neuroplasticiteit genoemd. Door omstandigheden kunnen pijndrempels (steeds) lager komen te liggen, waardoor pijn wordt gevoeld bij sensorische prikkels die normaal gesproken niet pijnlijk zijn, zoals aanraken of bewegen, en zelfs als spontane gebeurtenis (zonder een directe aanleiding). Deze verandering in het lichaam wordt ook wel centrale sensitisatie genoemd. Op het moment wordt er veel onderzoek naar chronische pijn gedaan (waaronder wijzelf binnen het GLAS cohort, maar ook andere onderzoekgroepen in de wereld), zodat we chronische pijn steeds beter leren begrijpen en we uiteindelijke mensen met pijn beter kunnen helpen.
centrale zenuwstelsel wordt ook wel neuroplasticiteit genoemd. Door omstandigheden kunnen pijndrempels (steeds) lager komen te liggen, waardoor pijn wordt gevoeld bij sensorische prikkels die normaal gesproken niet pijnlijk zijn, zoals aanraken of bewegen, en zelfs als spontane gebeurtenis (zonder een directe aanleiding). Deze verandering in het lichaam wordt ook wel centrale sensitisatie genoemd. Op het moment wordt er veel onderzoek naar chronische pijn gedaan (waaronder wijzelf binnen het GLAS cohort, maar ook andere onderzoekgroepen in de wereld), zodat we chronische pijn steeds beter leren begrijpen en we uiteindelijke mensen met pijn beter kunnen helpen.
Zie volgende nuttige links voor meer informatie over chronische pijn;
– https://www.pijnpatientennaar1stem.nl/wp-content/uploads/2017/11/Pati%C3%ABntenversie-Zorgstandaard-Chronische-Pijn-def-18112017.pdf (Zorgstandaard Chronische Pijn; patiëntversie)
– https://www.retrainpain.org/nederlands/ (Retrain Pain; een educative website)
– https://www.tamethebeast.org/ (Youtube filmpje; Tame the Beast – It’s time to rethink persistent pain (educatieve video in het Engels met NL ondertiteling)
– https://www.youtube.com/watch?v=gwd-wLdIHjs (Tedx presentatie door prof. dr. Lorimer Moseley; Waarom hebben we pijn? (Engels met NL ondertiteling)